酸性・アルカリ性とは
広辞苑第六版を引いてみます。
さん-せい【酸性】
酸の性質をもつこと。水溶液では、水素イオン濃度が水酸化物イオン濃度より大きいとき(すなわち水素イオン指数がpH<7であるとき)酸性である。⇔塩基性
えんき-せい【塩基性】
塩基の性質をもつこと。水溶液では、水酸化物イオン濃度が水素イオン濃度より大きいとき(すなわち水素イオン指数がpH>7であるとき)塩基性である。⇔酸性
塩基性とはアルカリ性の違う言い方です。化学用語としては塩基性を使うことがほとんどですが、ここではアルカリ性を用いて説明します。
それぞれの2文目に注目してみましょう。これはどういうことを言っているのでしょうか?
ここで純粋な水を考えます。このとき分子H2Oの一部は水素イオンH+と水酸化物イオンOH-に分かれています。この状態ではH+とOH-の数が等しく、中性と呼ばれる状態です。(pHだと7です)
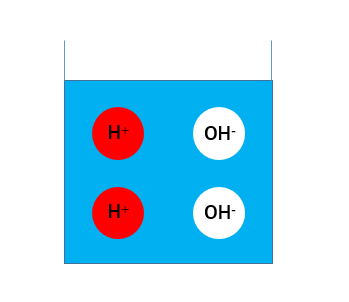 色に意味はありません。実際には1Lあたり10-7mol = 約6 × 1017個(60京個)のそれぞれのイオンが存在しています。
色に意味はありません。実際には1Lあたり10-7mol = 約6 × 1017個(60京個)のそれぞれのイオンが存在しています。この純水に二酸化炭素を溶かし炭酸水を作ります。
すると以下のような反応が起きます。
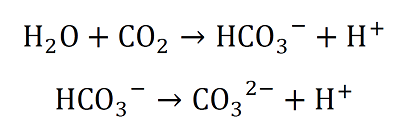
この反応も起こるのはわずかなのですが、これにより水素イオンH+が増えます。最初に示した定義を使うと、このとき酸性になります。 逆にOH-が増える反応が起きればH+が減り、その水溶液はアルカリ性を示すようになります。
ちなみによく使われるpHとは水素イオン濃度のことで、このHとは水素を意味しています。式で表すとこうなります。
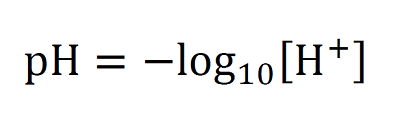 [H+]は水素イオン濃度で単位はmol/Lです。
[H+]は水素イオン濃度で単位はmol/Lです。長くなりましたが、つまり酸性かアルカリ性かは水素イオンの濃度で決まる!ということです。
以上を踏まえて、クイズに再チャレンジしてみては?











.jpg)